La atmósfera,es un fluido.
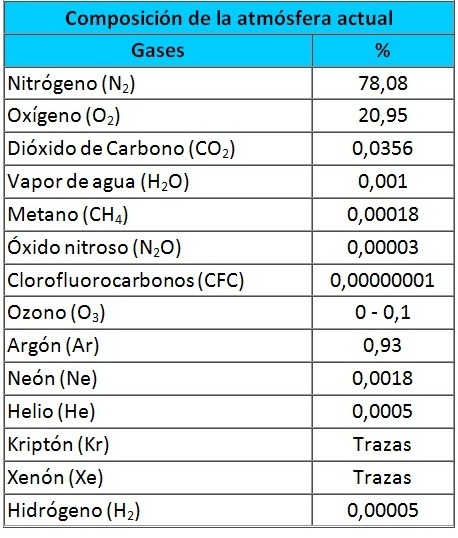
La atmósfera es la envoltura gaseosa que envuelve nuestro planeta. La composición de dicha atmósfera hasta unos 80km es constante, con el 78% de nitrógeno,21% de oxígeno y un 1% de otros gases como el argón,el dióxido de carbono,vapor de agua,metano,etc.Esos 80km forman la homoesfera. Por encima,está la heterosfera,donde la radiación solar y cósmica ioniza los gases atmosféricos que pasan a formar iones en una proporción muy distinta a la de la homoesfera.
Por tanto como vemos,la atmósfera es una mezcla de gases y su comportamiento por tanto se rige por las ecuaciones de los fluidos. En el colegio y en el instituto y por supuesto en la universidad,todos los que hayan estudiado ciencias habrán oído hablar de la ecuación de los gases ideales,esa ecuación en la cual se establece una relación entre la presión,el volumen,el número de moles(la masa) y la temperatura de un gas:
Esta ecuación funciona muy bien para presiones y temperaturas no muy altas,algo que en nuestra atmósfera se cumple,de ahí que los gases de nuestra atmósfera cumplan muy bien,con un error de menos del 0,5%,la ecuación de los gases ideales. Pero hemos comentado que esta ecuación es la ecuación de un gas ideal,y nuestra atmósfera es una mezcla de gases. No hay ningún problema,porque por la Ley de Dalton,sabemos que cuando tenemos una mezcla de gases ideales,la presión total que ejercen esos gases es la suma de las presiones parciales que ejerce cada gas y el número de moles total es la suma del número de moles de cada gas. Pero no nos vayamos por los cerros de Úbeda,y reescribamos esta ecuación para responder la pregunta de esta entrada. El número de moles de una sustancia en química,se calcula como la masa de esa sustancia dividida entre la masa molecular (si es una molécula) o atómica de dicha sustancia.Sustituyendo y pasando el volumen al otro lado tenemos:
Si nos fijamos en la última ecuación,vemos como hemos llegado a una expresión que relaciona la presión p del gas con su densidad,la constante R de los gases,la temperatura y la masa molecular de dicho gas. Por otra parte,hemos separado en la última ecuación el factor R/M,del cual vamos obtener una nueva constante.La constante R es la constante universal de los gases,pero si yo la divido entre la masa molecular del gas lo que obtengo es la constante para ese gas y es lo que vamos a obtener.
De la última ecuación se deduce que cuanto mayor sea la temperatura de un gas,menor es su densidad,y eso es lo que pasa en nuestra atmósfera,de ahí que el aire frío sea mucho más denso que el aire cálido.Esa segunda ecuación se denomina ecuación de estado del aire seco.
Pero vamos a fijarnos en la constante R*.Vemos que se obtiene dividiendo la constante R universal entre la masa molecular del gas,pero es que nuestra atmósfera está formada por varios gases.¿Cómo calculo yo la masa molecular de una mezcla de gases? Nos han enseñado a calcular la masa molecular de una sustancia,pero de una mezcla de sustancias puede resultar raro;sin embargo,es muy fácil.
Lo primero que vamos a calcular es el valor de dicha R pero para el aire seco,es decir,sin nada de vapor de agua.Para ello lo que hacemos es una media ponderada de las constantes de cada gas,teniendo en cuenta no solo el valor de la R para cada gas,sino también la proporción de dicho gas,en porcentaje en masa,en nuestra atmósfera. La R de cada gas la podemos sacar con la primera ecuación de la imagen anterior,y obtenemos lo siguiente para la R*:
Por tanto tenemos que en 1 metro cúbico de aire SECO tenemos algo más de 1kg de aire,todo esto a nivel del mar.
El aire húmedo,una mezcla de aire seco + vapor de agua:
Pero,¿qué ocurre cuando tenemos vapor de agua?Pues que ahora nuestra masa de aire es la suma de una masa de aire seco más vapor de agua. Evidentemente,esta presencia de vapor de agua va a cambiar el valor de nuestra constante R*. Vamos a calcular primero la densidad del vapor de agua dividiendo su masa molar entre su volumen molar a 1atmósfera de presión y 273K (0ºC):
Como podemos ver,el vapor de agua como gas,es menos denso que el aire seco.Esto en parte ya puede hacernos pensar que al aumentar el vapor de agua dentro de una masa de aire,se rebaja la densidad del aire.Pero vamos a demostrarlo. Hemos calculado la masa molecular del aire seco,pero esta masa molecular cambia si tenemos también vapor de agua,y cambia disminuyendo dicha masa molecular.El cambio,depende de la proporción de vapor de agua frente a la de aire seco:
Como vemos,M del aire húmedo,es mayor cuanto más pequeño es el denominador de la fracción,es decir,cuando la cantidad de vapor de agua es 0 ya que la constante R del vapor de agua es mucho más grande que la del aire seco:
Por tanto,cuanta más cantidad de vapor de agua tengamos,mayor es la constante R de nuestra masa de aire.Si recordamos una de las primeras ecuaciones que pusimos,y sustituimos el valor de R del aire húmedo nos queda:
De aquí vemos que:
-El valor de la densidad del aire es proporcional a la presión,siendo más denso el aire a presiones altas que a presiones bajas.
-Que la densidad del aire es inversamente proporcional a la constante R y de la temperatura de tal manera que como R del aire es mayor a mayor contenido de vapor de agua,el denominador es más grande y por tanto la densidad menor,de ahí que el aire húmedo sea menos denso que el aire seco.
La presencia de vapor de agua por tanto rebaja la densidad del aire al hacer la constante R del denominador,más grande.








Genial!
ResponderEliminarMuy bueno!
ResponderEliminaricreiblemente genial como maik wuasolki
ResponderEliminar¿por qué razón no se evalúa los casos con la misma condición de temperatura?.
ResponderEliminarEn esta entrada no concreto para ninguna temperatura.
ResponderEliminarBuenas,
ResponderEliminarCreo que hay una errata en la última ecuación.
La temperatura debería multiplicar a ambas masas de aire seco y vapor de agua. Sin embargo tal y como está escrita, solo afecta a la de vapor de agua.
Alguien me puede confirmar si estoy en lo cierto?
Estoy tratando de averiguar como calcular la densidad del aire en función de la temperatura y la humedad relativa.
Un saludo.
Tienes razón, es un error. A ver si un día tengo tiempo y lo cambio.
Eliminar